НИИ генетической и молекулярной эпидемиологии
ЛАБОРАТОРИЯ БИОХИМИЧЕСКОЙ ГЕНЕТИКИ И МЕТАБОЛОМИКИ
- Все новости21233
- Поступающим422
- Образование3263
- Наука3022
- Общество3097
- Университетская жизнь5307
- Медицина1238
- Трудоустройство516
- Непрерывное образование77
- Международная деятельность385
Информационные рубрики
Главный корпус
+7(4712)588-137
305041 К.Маркса,3, г.Курск
kurskmed@mail.ru
Приемная комиссия
58-81-38
305041 К.Маркса,3, г.Курск
СОТРУДНИКИ
Азарова Юлия Эдуардовна - заведующий лабораторией: к.м.н., доцент.
Клёсова Елена Юрьевна - младший научный сотрудник.
НАПРАВЛЕНИЯ НАУЧНЫХ ИССЛЕДОВАНИЙ ЛАБОРАТОРИИ:
- Исследование биохимических аспектов нарушений редокс-гомеостаза для понимания молекулярных основ патогенеза распространенных мультифакториальных заболеваний - сахарного диабета 2 типа, формирующихся на его фоне микро- и макрососудистых осложнений, артериальной гипертонии, инсульта, ишемической болезни сердца, атеросклероза.
- Использование современных методов лабораторной диагностики для изучения метаболома человека и его вклада в молекулярные механизмы развития социально значимых мультифакториальных заболеваний.
- Изучение взаимосвязи транскриптома, генома и метаболома в норме и патологии, а также исследование роли средовых факторов в формировании предрасположенности к многофакторным заболеваниям.
- Поиск новых молекулярно-генетических маркеров распространенных многофакторных заболеваний.
НАУЧНЫЕ ИССЛЕДОВАНИЯ, ВЫПОЛНЯЮЩИЕСЯ В ЛАБОРАТОРИИ
Диссертационные исследования, выполняемые на базе лаборатории
-
Диссертация Е.Ю. Клёсовой на соискание ученой степени кандидата биологических наук «Молекулярно-генетические детерминанты клеточного ответа на неупакованные белки и их патогенетическая роль в развитии сахарного диабета 2 типа» (научный руководитель – д.м.н., профессор А.В. Полоников).
-
Диссертация Я.Е. Корвяковой «Вклад полиморфных вариантов гена аминопептидазы ANPEP в развитие сахарного диабета 2 типа и его осложнений» (научный руководитель – д.м.н., доцент Ю.Э. Азарова).
Гранты, выполняемые на базе лаборатории:
- Проект РНФ №20-15-00227 «Концепция системной вовлеченности генов ферментов редокс-гомеостаза в молекулярные механизмы развития сахарного диабета 2 типа и его осложнений».
- Проект РНФ №22-25-00585 «Молекулярно-генетические детерминанты клеточного ответа на неупакованные белки и их патогенетическая роль в развитии сахарного диабета 2 типа: пилотное исследование».
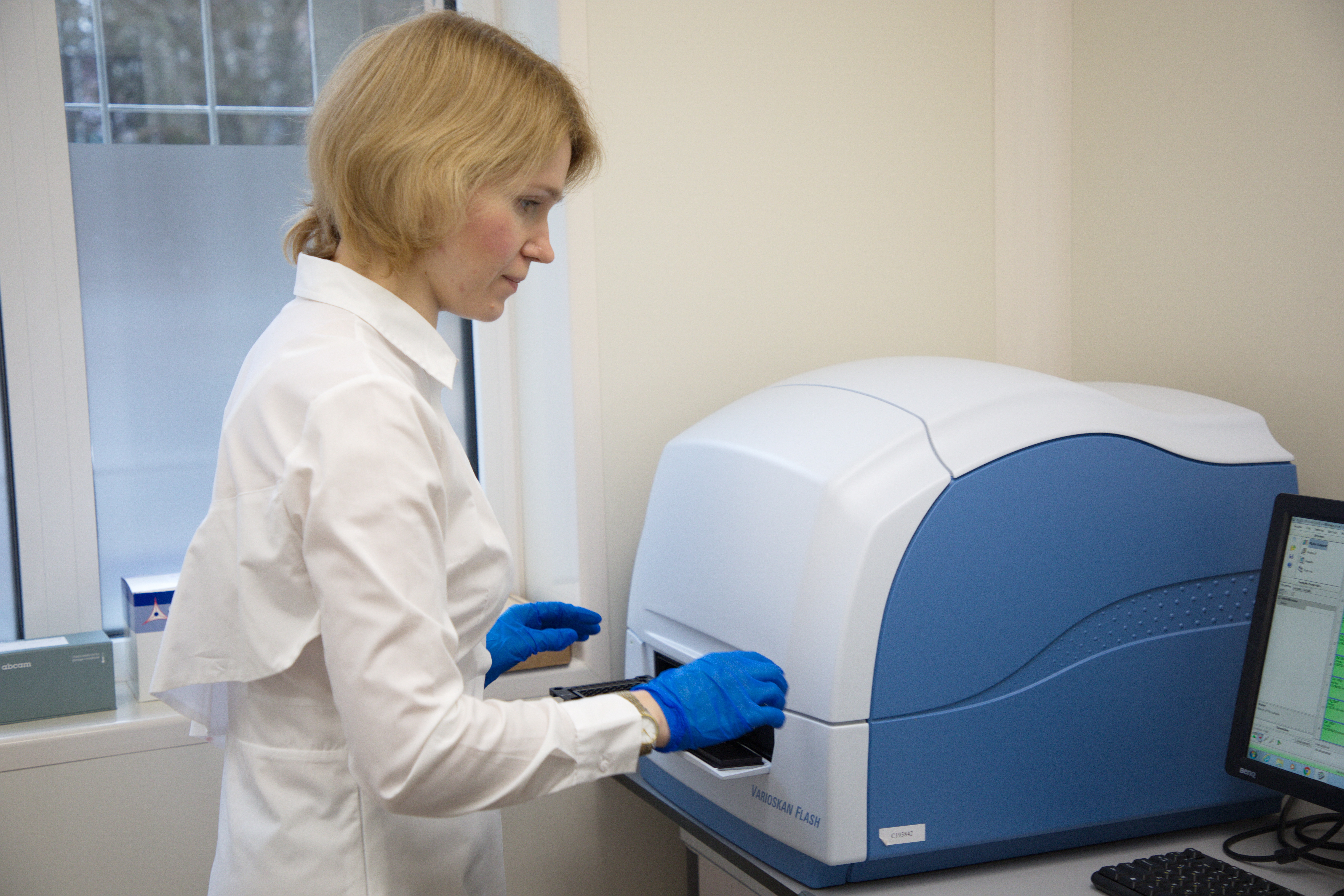
ОСНОВНОЕ ОБОРУДОВАНИЕ ЛАБОРАТОРИИ И ЕГО ВОЗМОЖНОСТИ
Оборудование лаборатории включает всю необходимую приборную базу для количественного анализа метаболитов в различных биологических образцах в 96-луночном формате: микропланшетный ридер Varioscan Flash Thermo Fisher Scientific, промыватель планшетов Thermo Fisher Scientific, настольный термостат и шейкер, микроцентрифуги, настольные центрифуги для получения плазмы из цельной крови, биохимический полуавтоматический анализатор Clima RAL.
Технологии, применяемые в лаборатории: иммуноферментный анализ, колориметрический, флуориметрический, люминесцентный методы количественного содержания цитокинов, гормонов, метаболитов в плазме, сыворотке крови, клеточном лизате.
ОСНОВНЫЕ ДОСТИЖЕНИЯ ЛАБОРАТОРИИ
Сотрудниками лаборатории впервые проведено масштабное генетико-эпидемиологическое исследование по оценке вовлеченности полиморфных вариантов генов ферментов метаболизма глутатиона и прооксидантных ферментов в молекулярные механизмы развития сахарного диабета 2 типа и его осложнений (1, 2, 3, 4). Между полиморфными вариантами генов ферментов метаболизма глутатиона и прооксидантных ферментов впервые установлены выраженные межрасовые и межэтнические различия как в частотах минорных аллелей, гаплотипов и величинах неравновесия по сцеплению, так и в характере их взаимосвязей с предрасположенностью к сахарному диабету 2 типа. Впервые выявлены ассоциации сахарного диабета 2 типа с 11 полиморфными вариантами 8 генов ферментов метаболизма глутатиона и 8 SNPs генов 6 прооксидантных ферментов, многие из которых были успешно реплицированы в независимых популяциях мира (5, 6). Идентифицированы гаплотипы генов ферментов метаболизма глутатиона и прооксидантных ферментов, ассоциированные с повышенным и пониженным риском развития сахарного диабета 2 типа и его осложнений (7). Впервые в России проведено репликативное исследование ассоциаций СД2 с 18 полиморфными вариантами генов, установленными крупными международными консорциумами в результате полногеномных ассоциативных исследований, в результате 12 локусов показали статистически значимые ассоциации с развитием болезни у жителей Центральной России. Впервые обнаружено, что, наряду с известными средовыми факторами риска сахарного диабета 2 типа, повышенный риск развития болезни связан с недостаточным употреблением в пищу белка. Показано, что риск развития СД2 у лиц с нормальной массой тела связан с недостаточным потреблением белка и клетчатки на фоне избыточного потребления жирной пищи, в отличие от пациентов с избыточным весом, высококалорийное питание которых связано с избыточным употреблением углеводов. Впервые установлено, что полиморфные варианты ГФМГ и ГПФ являются значимыми модификаторами риска развития сахарного диабета 2 типа на фоне недостаточного употребления пищи, богатой белком и свежими овощами и фруктами. Впервые выявлены межгенные и генно-средовые взаимодействия в системе редокс-гомеостаза, которые совместно с известными генами-кандидатами сахарного диабета 2 типа вовлечены в полигенную предрасположенность к болезни и вносят существенный вклад в детерминацию развивающихся на его фоне осложнений.
В настоящее время сотрудники лаборатории занимаются изучением полиморфных вариантов генов шаперонов и генов ответа на несвернутые белки в популяции жителей Центральной России. Анализ ассоциаций изучаемых SNPs с риском развития СД2 у жителей Центральной России установил ассоциации генотипов rs1882019-A/A HSP90B1 и rs1046495-T/C GFER с пониженным риском развития заболевания (8). В то же время минорные аллели rs1043618-С HSPA1A и rs196914-C ERN1 ассоциировались с повышенным риском СД2 независимо от пола, возраста и ИМТ пациентов (9). Стратификационный анализ по полу показал, что ассоциация варианта rs1882019 HSP90B1 характерна только для женщин и отсутствует у мужчин. Протективным эффектом в плане риска развития СД2 у женщин обладал и генотип rs899997-T/G SLCO1B1: OR 0.75, 95% CI 0.60-0.95, P=0.03. Генотипы трех полиморфных вариантов, а именно, rs10778306-A/G HSP90B1, rs3095154-G/A HSPA1A и rs7838717-T/T HSF1 были связаны с повышенным риском развития заболевания у пациенток с СД2. Анализ ассоциаций SNPs в группах пациентов с учетом индекса массы тела обнаружил, что носительство генотипа rs3131377-G/A HSPA1A связано с пониженным риском СД2 только у лиц с ИМТ<25 кг/м2, то есть с нормальной массой тела, тогда как рисковый эффект генотипа rs3757971-C/C HSF1 в отношении предрасположенности к заболеванию реализуется только у пациентов с избыточной массой тела и ожирением. Анализ генно-средовых взаимодействий установил синергизм ряда средовых факторов риска и полиморфизма генов шаперонов и их регуляторов. Так, с повышенным риском СД2 ассоциировано сочетание гиподинамии и носительства генотипа rs7838717-T/T HSF1, дефицита клетчатки в пище и наличие генотипа rs1165682-A/T HSP90B1, избытка потребляемых углеводов и носительство генотипа rs3095154-G/A HSPA1A, а также сочетание злоупотребления рафинированным сахаром и носительства генотипа rs10778306-A/G HSP90B1 (10). В то же время протективный эффект носительства генотипов rs11621560-A/C HSP90AB1, rs1165682-A/T и rs1882019-A/A HSP90B1 в отношении риска заболевания реализуется в комбинации с ежедневным потреблением достаточного количества свежей растительной пищи и не превышающим нормы потреблением жиров и углеводов, соответственно. Функциональное аннотирование полиморфных вариантов изучаемых генов, выполненное с ресурсов eQTLGen и mQTLdb показал, что аллели rs196914-С и rs9911085-С гена ERN1 связаны со значительным снижением экспрессии ERN1 в цельной крови. Кроме того, аллель rs1046495-С гена GFER обладает выраженным регуляторным потенциалом и ассоциируется с более высокими уровнями мРНК GFER в широком спектре тканей, имеющих отношение к патогенезу СД2. Анализ влияния экспрессии рисковых аллелей rs3757971-C и rs7838717-Т гена HSF1 показал, что носительство данных аллелей ассоциируется со снижением экспрессии шаперонов HSP90B1, RPS19BP1 и HSPA5, принимающих непосредственное участие в процессах ATF6-опосредованного ответа клетки на неупаковынные белки (GO:0036500), посттрансляционной укладки белка de novo (GO:0051084), клеточного ответа на недостаток глюкозы (GO:0042149), негативной регуляции апоптотического процесса (GO:0043066) и посттрансляционной модификации белка (GO:0043687). Таким образом, связанные с предрасположенностью к СД2 ДНК-маркеры в генах ERN1, GFER и HSF1 связаны с изменениями в экспрессии генов, участвующих в ответе на несвернутые белки, что является отличительной чертой патогенеза сахарного диабета 2 типа.

Сотрудники лаборатории регулярно проходят обучение в области генетики и молекулярной биологии:
- Жидкостная биопсия в клинической практике, Гейдельберг, Германия, 2018
- Современные достижения медицинской генетики, Москва, РМАПО, 2018
- Основы молекулярно-генетических и генно-инженерных методов, НИЦ «Курчатовский институт», Москва, 2022
- Введение в технологии NGS. Работа с данными секвенирования, АНО «Институт синтетической биологии», Москва, 2023
- Python и R для анализа данных, АНО «Институт синтетической биологии», Москва, 2023.
ИЗБРАННЫЕ ПУБЛИКАЦИИ СОТРУДНИКОВ ЛАБОРАТОРИИ ЗА ПОСЛЕДНИЕ 5 ЛЕТ
- Azarova I, Polonikov A, Klyosova E. Molecular Genetics of Abnormal Redox Homeostasis in Type 2 Diabetes Mellitus. Int J Mol Sci. 2023 Mar 1;24(5):4738. doi: 10.3390/ijms24054738.
- Kononov S, Azarova I, Klyosova E, Bykanova M, Churnosov M, Solodilova M, Polonikov A. Lipid-Associated GWAS Loci Predict Antiatherogenic Effects of Rosuvastatin in Patients with Coronary Artery Disease. Genes (Basel). 2023 Jun 13;14(6):1259. doi: 10.3390/genes14061259.
- Azarova I, Klyosova E, Polonikov A. Single Nucleotide Polymorphisms of the RAC1 Gene as Novel Susceptibility Markers for Neuropathy and Microvascular Complications in Type 2 Diabetes. Biomedicines. 2023 Mar 22;11(3):981. doi: 10.3390/biomedicines11030981.
- Zhabin S, Lazarenko V, Azarova I, Klyosova E, Bykanova M, Chernousova S, Bashkatov D, Gneeva E, Polonikova A, Churnosov M, Solodilova M, Polonikov A. The Joint Link of the rs1051730 and rs1902341 Polymorphisms and Cigarette Smoking to Peripheral Artery Disease and Atherosclerotic Lesions of Different Arterial Beds. Life (Basel). 2023 Feb 10;13(2):496. doi: 10.3390/life13020496.
- Klyosova E, Azarova I, Polonikov A. A Polymorphism in the Gene Encoding Heat Shock Factor 1 (HSF1) Increases the Risk of Type 2 Diabetes: A Pilot Study Supports a Role for Impaired Protein Folding in Disease Pathogenesis. Life (Basel). 2022 Nov 20;12(11):1936. doi: 10.3390/life12111936.
- Azarova I, Klyosova E, Polonikov A. Association between RAC1 gene variation, redox homeostasis and type 2 diabetes mellitus. Eur J Clin Invest. 2022 Aug;52(8):e13792. doi: 10.1111/eci.13792.
- Vorvul AO, Bobyntsev II, Medvedeva OA, Mukhina AY, Svishcheva MV, Azarova IE, Andreeva LA, Myasoedov NF. ACTH(6-9)-Pro-Gly-Pro ameliorates anxiety-like and depressive-like behaviour and gut mucosal microbiota composition in rats under conditions of chronic restraint stress. Neuropeptides. 2022 Jun;93:102247. doi: 10.1016/j.npep.2022.102247.
- Polonikov A, Bocharova I, Azarova I, Klyosova E, Bykanova M, Bushueva O, Polonikova A, Churnosov M, Solodilova M. The Impact of Genetic Polymorphisms in Glutamate-Cysteine Ligase, a Key Enzyme of Glutathione Biosynthesis, on Ischemic Stroke Risk and Brain Infarct Size. Life (Basel). 2022 Apr 18;12(4):602. doi: 10.3390/life12040602.
- Bykanova MA, Solodilova MA, Azarova IE, Klyosova EY, Bushueva OY, Polonikova AA, Churnosov MI, Polonikov AV. Genetic variation at the catalytic subunit of glutamate cysteine ligase contributes to the susceptibility to sporadic colorectal cancer: a pilot study. Mol Biol Rep. 2022 Jul;49(7):6145-6154. doi: 10.1007/s11033-022-07406-0.
- Azarova I, Klyosova E, Polonikov A. The Link between Type 2 Diabetes Mellitus and the Polymorphisms of Glutathione-Metabolizing Genes Suggests a New Hypothesis Explaining Disease Initiation and Progression. Life (Basel). 2021 Aug 28;11(9):886. doi: 10.3390/life11090886. PMID: 34575035; PMCID: PMC8466482.
- Azarova IE, Klyosova EY, Polonikov AV. Polymorphic variants of glutathione reductase - new genetic markers of predisposition to type 2 diabetes mellitus. Ter Arkh. 2021 Oct 15;93(10):1164-1170. Russian. doi: 10.26442/00403660.2021.10.201101. PMID: 36286817.
- Zhabin S, Lazarenko V, Azarova I, Klyosova E, Bykanova M, Chernousova S, Bashkatov D, Gneeva E, Polonikova A, Churnosov M, Solodilova M, Polonikov A. The Joint Link of the rs1051730 and rs1902341 Polymorphisms and Cigarette Smoking to Peripheral Artery Disease and Atherosclerotic Lesions of Different Arterial Beds. Life (Basel). 2023 Feb 10;13(2):496. doi: 10.3390/life13020496. PMID: 36836853; PMCID: PMC9961460.
- Vorvul AO, Bobyntsev II, Medvedeva OA, Mukhina AY, Svishcheva MV, Azarova IE, Andreeva LA, Myasoedov NF. ACTH(6-9)-Pro-Gly-Pro ameliorates anxiety-like and depressive-like behaviour and gut mucosal microbiota composition in rats under conditions of chronic restraint stress. Neuropeptides. 2022 Jun;93:102247. doi: 10.1016/j.npep.2022.102247. Epub 2022 Apr 21. PMID: 35487169.
- Klyosova E, Azarova I, Polonikov A. A Polymorphism in the Gene Encoding Heat Shock Factor 1 (HSF1) Increases the Risk of Type 2 Diabetes: A Pilot Study Supports a Role for Impaired Protein Folding in Disease Pathogenesis. Life (Basel). 2022 Nov 20;12(11):1936. doi: 10.3390/life12111936. PMID: 36431071; PMCID: PMC9694443.
- Azarova I, Klyosova E, Lazarenko V, Konoplya A, Polonikov A. Genetic variants in glutamate cysteine ligase confer protection against type 2 diabetes. Mol Biol Rep. 2020 Aug;47(8):5793-5805. doi: 10.1007/s11033-020-05647-5.
- Азарова Ю.Э., Клёсова Е.Ю., Чурилин М.И., Самгина Т.А., Конопля А.И., Полоников А.В. Генетико-биохимическое исследование роли гамма-глутамилциклотрансферазы в формировании предрасположенности к сахарному диабету 2-го типа. Экологическая генетика. 2020. Т. 18. № 2. С. 215-228.
- Азарова Ю.Э., Клёсова Е.Ю., Лазаренко В.А., Конопля А.И., Полоников А.В. Полиморфизм rs11927381 и сахарный диабет 2-го типа: вклад курения в реализацию предрасположенности к заболеванию. Бюллетень экспериментальной биологии и медицины. 2019. Т. 168. № 9. С. 277-281.
- Азарова Ю.Э., Клёсова Е.Ю., Самгина Т.А., Сакали С.Ю., Коломоец И.И., Азарова В.А., Конопля А.И., Полоников А.В. Роль полиморфных вариантов гена CYBA в патогенезе сахарного диабета 2 типа. Медицинская генетика. 2019. Т. 18. № 8 (205). С. 37-48..
- Азарова, Ю. Э., Клёсова, Е. Ю., Сакали, С. Ю., Ковалев, А. П. (2020). Вклад полиморфизма rs11927381 гена IGF2BP2 в патогенез сахарного диабета 2 типа. Научные результаты биомедицинских исследований, 6(1).
- Азарова, Ю. Э., Клёсова, Е. Ю., Бушуева, О. Ю., Самгина, Т. А., Азарова, В. А., Конопля, А. И., Полоников, А. В. (2020). Полиморфный вариант гена GPX2 (rs4902346) и предрасположенность к сахарному диабету 2-го типа. Медицинская генетика, 19(2), 17-27.
- Азарова, Ю. Э. (2020). Полиморфные варианты rs4712524 и rs6931514 гена CDKAL1: связь с риском развития сахарного диабета 2 типа в русской популяции. Естественные и технические науки, (9), 28-37.
- Азарова, Ю. Э., Клёсова, Е. Ю., Коломоец, И. И., Азарова, В. А., Ивакин, В. Е., Конопля, А. И., Полоников, А. В. (2020). Полиморфные варианты гена бета-цепи цитохрома b-245 НАДФН-оксидазы: связь с показателями редокс-гомеостаза и риском развития сахарного диабета 2-го типа. Генетика, 56(7), 834-841.
- Азарова, Ю. Э., Клёсова, Е. Ю., Полоников, А. В. (2021). Полиморфный вариант rs4430796 гена HNF1B: пол-специфические, ИМТ-зависимые ассоциации с показателями метаболизма глюкозы, редокс-гомеостаза и риском сахарного диабета 2 типа. Медицинская генетика, 20(1), 25-36.
Патенты на изобретения
- Применение физиологического трипептида из глютаминовой кислоты, цистеина и глицина TAD600 для лечения острого небилиарного панкреатита (RU 2696286 C1)
- Cпособ прогнозирования риска развития диабетической дистальной полинейропатии у женщин с сахарным диабетом 2 типа на основе генотипирования полиморфизма rs7784465 гена RAC1 (RU 2787273 C1)
- Способ прогнозирования риска развития диабетической ретинопатии у мужчин с сахарным диабетом 2 типа на основе генотипирования полиморфизма rs836478 гена RAC1 (RU 2786820 C1)
- Способ прогнозирования риска развития сахарного диабета 2 типа у жителей Центральной России на основе генотипирования полиморфизма rs755892 гена DNAJB1 (RU 2803637 C1)
- Способ прогнозирования риска развития сахарного диабета 2 типа у жителей Центральной России на основе генотипирования полиморфизма rs11073891 гена ANPEP (RU 2803636 C1)
СТУДЕНЧЕСКАЯ НАУКА В ЛАБОРАТОРИИ БИОХИМИЧЕСКОЙ ГЕНЕТИКИ И МЕТАБОЛОМИКИ
В работе лаборатории активное участие принимают студенты: Постникова мария Игоревна (студентка 6 курса педиатрического факультета), Лазарев Дмитрий Романович (студент лечебного факультета, 2 курс); Ильина Елизавета Андреевна (студентка лечебного факультета), Макаренко Виктор Викторович (студент педиатрического факультета, 4 курс), Хабибулин Рамис (студент лечебного факультета, 4 курск), Корвякова Ярослава Евгеньевна (студентка лечебного факультета, с 2022 г. - ординатор медико-генетического научного центра имени Бочкова (г. Москва), соискатель НИИ ГМЭ), Шкурат Екатерина Анатольевна (студентка лечебного факультета, с 2023 г. - ординатор КГМУ), Дудченко Светлана Сергеевна (студентка лечебного факультета, с 2023г. - заочный аспирант кафедры хирургических болезней №1), Скляренко Ольга (студентка педиатрического факультета, 4 курс), Воробьева Ангелина (студентка педиатрического факультета, 4 курс).
Выполняется дипломная работа студенткой 6 курса педиатрического факультета Постниковой Марией Игоревной (совместное руководство Ю.Э. Азаровой и заведующего кафедрой внутренних болезней №2 профессора В.П. Михина).


Статьи WoS/Scopus с участием студентов:
- Клёсова, Е. Ю., Шкурат, Е. А., Азарова, Ю. Э., & Полоников, А. В. (2021). Полиморфизм rs1046495 гена GFER - новый генетический маркер предрасположенности к сахарному диабету 2-го типа. Бюллетень экспериментальной биологии и медицины, 172(11), 627-631.
- Azarova, I., Shkurat, E., Klyosova, E., & Polonikov, A. (2021). NOX Subunit Gene Polymorphisms and the Risk of Chronic Artery Disease in Type 2 Diabetes Patients. American Heart Journal, 242, 153.
- Azarova, I., Klyosova, E., Shkurat, E., & Polonikov, A. (2021). Polymorphic Variants in gamma-glutamyltransferase 6 as New Genetic Markers of Type 2 Diabetes Mellitus. Metabolism-Clinical and Experimental, 116.
- Азарова, Ю. Э. Полиморфные варианты гена гамма-глутамилтрансферазы 6: связь с показателями гликемии, редокс-гомеостаза плазмы крови и риском развития сахарного диабета 2 типа / Ю. Э. Азарова, Е. Ю. Клёсова, Е. А. Шкурат [и др.] // Естественные и технические науки. – 2021. – № 5 (156). – С. 88-98.
- Клёсова Е.Ю., Азарова Ю.Э., Ильина Е.А., Горяйнова Н.В., Полоников А.В. (2023) Ассоциация полиморфных вариантов гена белка теплового шока HSPA5 с риском развития сахарного диабета 2 типа. Бюллетень экспериментальной биологии и медицины (принята к публикации)
- Азарова Ю.Э., Постникова М.И., Макаренко В.В., Клёсова Е.Ю., Полоников А.В. (2023) Связь однонуклеотидного полиморфизма rs4880 гена SOD2 с развитием микрососудистых осложнений сахарного диабета 2-го типа. Научные результаты биомедицинских исследований (принята к публикации)
КОНТАКТНЫЕ ДАННЫЕ
г. Курск 305041
Ул. Ямская, 18
Курский государственный медицинский университет. Фармацевтический корпус. 1 этаж.
Email: azarovaje@kursksmu.net





